Contoh Senyawa Elektrolit Kuat dan Elektrolit Lemah



PANGKALPINANG, Lintaasbabel.iNews.id - Contoh senyawa elektrolit kuat dan elektrolit lemah. Elektrolit adalah salah satu zat yang tak terpisahkan dalam berbagai aspek kehidupan. Zat ini memiliki kemampuan unik untuk menghantarkan arus listrik melalui larutan.
Secara garis besar, larutan elektrolit dapat dibagi menjadi dua kategori utama, yakni elektrolit kuat dan elektrolit lemah. Dalam artikel ini, kita akan menggali lebih dalam mengenai perbedaan mendasar antara keduanya dan melihat contoh-contoh yang mewakili karakteristik khas masing-masing.
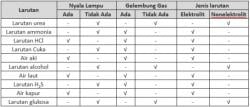
Senyawa elektrolit kuat dan elektrolit lemah memiliki perbedaan signifikan dalam kemampuan mereka untuk menghantarkan arus listrik dalam larutan.
Senyawa elektrolit kuat sepenuhnya terurai menjadi ion-ion dalam larutan, sementara elektrolit lemah hanya sebagian kecil yang terurai. Ini menciptakan perbedaan dalam konduktivitas listrik dan memberikan wawasan lebih lanjut tentang sifat kimia senyawa-senyawa ini ketika berinteraksi dengan air.
Senyawa elektrolit kuat adalah senyawa yang dapat sepenuhnya terurai menjadi ion-ion ketika dilarutkan dalam air. Ini berarti, larutan senyawa elektrolit kuat memiliki konsentrasi ion yang tinggi dan memiliki kemampuan yang sangat baik untuk menghantarkan arus listrik. Ini terjadi karena ikatan antara atom-atom dalam senyawa tersebut terlalu lemah untuk bertahan dalam bentuk molekul utuh, dan secara efektif dipecah oleh air menjadi ion-ion.
Asam Klorida (HCl)
Ketika HCl dilarutkan dalam air, ia terurai menjadi ion H+ dan Cl-. Kedua ion ini memungkinkan larutan menjadi konduktor listrik yang baik.
Natrium Klorida (NaCl)
Larutan garam dapur juga mengandung ion-ion Na+ dan Cl-. Garam dapur adalah contoh umum senyawa elektrolit kuat.
Asam Sulfat (H2SO4)
Saat asam sulfat dilarutkan, ion-ion H+ dan ion sulfat (SO4"2-) terbentuk, menciptakan kemampuan konduksi listrik yang tinggi.
Editor : Muri Setiawan