Senyawa Garam (Pengertian, Jenis, dan Contohnya)



PANGKALPINANG, Lintasbabel.iNews.id - Senyawa garam, pengertian beserta jenis dan contoh-contohnya bisa kamu simak dalam pembahasan kali ini. Tentu saja hal ini akan menambah khasanah keilmuan kamu para pelajar Sekolah Menengah Umum (SMU) pada mata pelajaran Kimia.
Menurut Kamus Besar Bahasa Indonesia (KBBI), garam adalah hasil reaksi asam dengan basah, yaitu satu atau lebih atom hidrogen pada asam diganti oleh satu atau lebih kation suatu basah.
Dalam ilmu Kimia, garam adalah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), keduanya akan membentuk senyawa netral (tanpa bermuatan).
Berdasarkan sifatnya, garam dapat dibedakan menjadi tiga macam, yakni garam netral, garam asam dan garam basa.
Garam asam adalah garam yang terbentuk jika hanya sebagian hidrogen dari asam penyusun garam tergantikan oleh logam atau kation lain, jadi masih terdapat sisa sifat asam pada produk garam tersebut.

Garam basa adalah garam yang terbentuk jika tidak semua gugus OH dari basa penyusun garam tersebut ternetralkan oleh suatu radikal asam (sifat basa/anion penyusun garam lebih kuat daripada sifat kation/asam penyusunnya).
Sedangkan garam netral adalah garam yang terbentuk dari reaksi netralisasi antara asam dan basa secara sempurna. Biasanya garam ini merupakan hasil reaksi asam kuat dengan basa kuat.
hidrolisis garam adalah terurainya garam dalam air yang menghasilkan asam dan atau basa. Dimana pH masing-masing larutan tergantung dari sifat senyawa yang terlarut dalam air.
Berikut 4 reaksi dirolisis kimia pada garam:
1. Garam yang berasal dari asam lemah dan basa kuat bersifat netral dan memiliki pH = 7, yang artinya tidak terjadi hidrolisis.
2. Garam dari asam kuat dan basa lemah, di mana garam ini akan memiliki pH < 7 alias bersifat asam.
3. Garam dari asam lemah dan basa kuat, di mana garam ini akan memiliki pH > 7 alias bersifat basa.
4. Garam dari asam lemah dan basa lemah, di mana sifat asam atau basanya bergantung pada besarnya Ka/Kb -nya.
Selanjutnya, adalah 3 klasifikasi hidrolisis garam, yaitu hidrolisis sempurna (hidrolisis total), hidrolisis sebagian (hidrolisis parsial) dan tidak terhidrolisis.
Hidrolisis sempurna terjadi dari asam lemah dan basa lemah, sedangkan kebalikannya tidak terhidrolisis terjadi dari asam kuat dan basa kuat. Sementara, hidrolisis parsial terdiri dari asam lemah, basa kuat atau asam kuat, basa lemah. Contoh garam yang mengalami hidrolisis sebagian dan bersifat asam adalah NH4Cl atau ammonium Klorida.
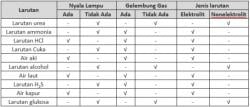
1. Larutan garam yang bersifat netral yaitu garam yang terbentuk dari asam kuat dan basa kuat atau terbentuk dari asam lemah dan basa lemah. Contoh : NaCl , CH3COONH4.
2. Larutan garam yang bersifat asam yaitu garam yang terbentuk dari asam kuat dan basa lemah. Contoh : NH4Cl, Al2(SO4)3.
3. Larutan garam yang bersifat basa yaitu garam yang terbentuk dari basa kuat dan asam lemah. Contoh : CH3COONa, Na2CO3.
Adapun sifat-sifat garam, adalah:
1. Mampu menghantarkan arus listrik.
2. Tidak mengubah warna lakmus merah maupun biru.
3. Jika terbentuk dari asam kuat dan basa lemah, maka garam akan bersifat asam. dan sebaliknya, jika terbentuk dari asam lemah dan basa kuat, maka garam akan bersifat basa.
4. Bila terbentuk dari asam kuat dan basa kuat, maka garam akan bersifat netral, misalnya garam dapur (NaCl).
5. Memiliki pH 7.
Untuk menghitung nilai pH hidrolisis garam, yaitu dengan persamaan-persamaan berikut:
Di mana, Kh dapat dicari dengan persamaan:
sehingga, persamaan mencari nilai tetapan hidrolisis sebagai berikut
Keterangan: = tetapan hidrolisis asam kuat, basa lemah; Kw= ionisasi air; Kb=ionisasi basa; Mg= Konsentrasi ion yang lemah
Di mana, Kh dapat dicari dengan persamaan:
sehingga, persamaan mencari nilai tetapan hidrolisis sebagai berikut
Di mana, Kh dapat dicari dengan persamaan:
sehingga, persamaan mencari nilai tetapan hidrolisis sebagai berikut
Keterangan: = tetapan hidrolisis asam lemah, basa kuat; Kw= ionisasi air; Ka= ionisasi asam; Mg= Konsentrasi ion yang lemah
Jika Ka>Kb
Keterangan: = tetapan hidrolisis asam kuat, basa lemah; Kw= ionisasi air; Kb=ionisasi basa; Ka= ionisasi asam
Jika Ka<Kb
Keterangan: = tetapan hidrolisis asam lemah, basa kuat; Kw= ionisasi air; Ka= ionisasi asam; Kb= ionisasi basa
Berikut ini contoh larutan garam dalam kehidupan sehari-hari:
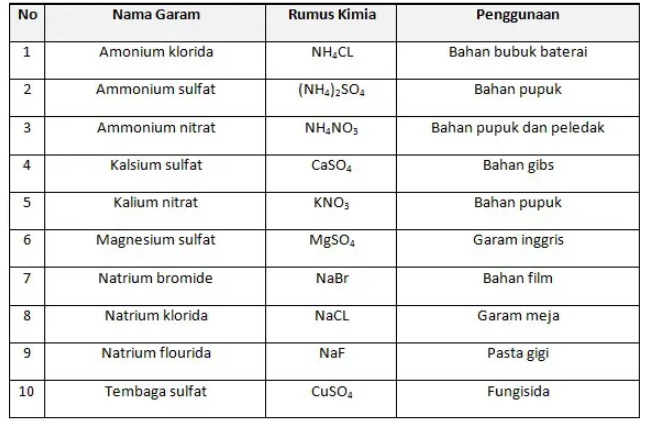
Demikianlah ulasan tentang senyawa garam, lengkap dengan jenis dan contohnya. Semoga bermanfaat!
Editor : Muri Setiawan