Teori Asam Basa Menurut Ahli, Lengkap dengan Karakteristik dan Contohnya di Kehidupan Sehari-hari



2. Teori Asam Basa Bronsted-Lowry
Tahun 1923, seorang ahli dari Denmark bernama Johanes N. Bronsted dan Thomas M. Lowry dari Inggris mengajukan konsep tentang asam basa secara terpisah, tapi dalam waktu bersamaan. Konsep ini kemudian dikenal dengan teori asam basa Bronsted Lowry.
Bronsted dan Lowry mendefinisikan asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H+).
Menurut teori asam basa Bronsted Lowry, asam adalah zat yang cenderung mendonorkan ion H+, sedangkan basa adalah zat yang cenderung menerima ion H+ dari zat lain.
Dua ilmuwan ini juga mencetuskan teori asam basa konjugasi. Asam konjugasi adalah basa yang menerima ion H+, sedangkan basa konjugasi adalah asam yang telah mendonorkan atau melepaskan ion H+.
Sebagai contoh, ketika asam asetat (CH3COOH) dilarutkan dalam air, maka akan terjadi reaksi berikut ini:
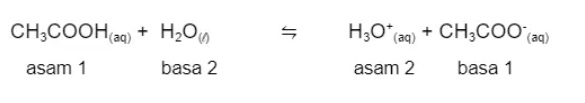
Sementara H3O+ adalah asam konjugasi karena kelebihan ion H+ dibandingkan zat asalnya, yaitu H2O. Pasangan CH3COOH dan CH3COO- disebut pasangan asam basa konjugasi.
Dalam teori asam basa Bronsted Lowry, ada kondisi dan reaksi tertentu di mana suatu senyawa dapat berperan sebagai basa meskipun tidak mengandung OH-, sedangkan dalam reaksi lainnya senyawa tersebut berperan sebagai basa. Senyawa yang memiliki sifat amfiprotik dan berperan sebagai amfoter.
Editor : Muri Setiawan