Teori Asam Basa Menurut Ahli, Lengkap dengan Karakteristik dan Contohnya di Kehidupan Sehari-hari



PANGKALPINANG, Lintasbabel.iNews.id - Teori Asam Basa menurut ahli, bisa kamu jumpai dalam artikel berikut ini. Sebelumnya, kita akan membahas apa itu asam basa.
Asam dan Basa adalah larutan elektrolit yang memiliki ciri khas tersendiri, dimana secara kimia asam adalah zat elektrolit yang jika dilarutkan ke dalam air akan menghasilkan ion hidrogen (H+). Sementara Basa, adalah zat elektrolit yang dapat menghasilkan ion hidroksida (OH-) jika dilarutkan ke dalam air.

Contoh asam adalah air jeruk, air aki, asam cuka, minuman berkarbonasi. Sedangkan contoh basa seperti sabun, sampo, deterjen, dan larutan amonia.
Karakteristik Asam
Karakteristik Basa
Berikut ini sejumlah teori asam basa menurut ahli, yang berhasil kami rangkum dari berbagai sumber.
Terdapat 3 teori yang menjelaskan tentang asam basa, yakni:
1. Teori Arrhenius
Ahli kimia yang berasal dari Swedia yaitu Svante Arrhenius menghubungkan sifat keasaman dengan ion hydrogen (H+) pada tahun 1884. Asam Arrhenius adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H+ dalam larutan, misalnya asam klorida (HCl) dan asam asetat (CH3COOH). Dengan persamaan reaksi dari asam klorida dan asam asetat sebagai berikut :
HCl (aq) → H+ (aq) + Cl (aq)
CH3COOH (aq) → Ch3COO– (aq) + H+ (aq)
Berdasarkan persamaan reaksi tersebut maka ciri khasnya adalah dalam pelarut air zat tersebut mengion menjadi hidrogen yang bermuatan positif dengan lambing H+ dan ion yang bermuatan negative akan disebut dengan sisa asam.
Disamping itu, basa Arrhenius adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion OH–. Misalnya natrium hidroksida (NaOH) dan ammonium hidroksida (NH4OH). Dimana, persamaan reaksi basa tersebut antara lain:
NaOH (aq) → Na+ (aq) + OH– (aq)
NH4OH (aq) → Nh4+ (aq) + OH– (aq)
Basa yang dalam larutan banyak menghasilkan ion OH- disebut basa kuat, sedangkan yang sedikit menghasilkan ion OH- disebut dengan basa lemah. Tidak semua senyawa yang dalam rumus kimianya terdapat gugus hidroksida termasuk golongan basa.
2. Teori Asam Basa Bronsted-Lowry
Tahun 1923, seorang ahli dari Denmark bernama Johanes N. Bronsted dan Thomas M. Lowry dari Inggris mengajukan konsep tentang asam basa secara terpisah, tapi dalam waktu bersamaan. Konsep ini kemudian dikenal dengan teori asam basa Bronsted Lowry.
Bronsted dan Lowry mendefinisikan asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H+).
Menurut teori asam basa Bronsted Lowry, asam adalah zat yang cenderung mendonorkan ion H+, sedangkan basa adalah zat yang cenderung menerima ion H+ dari zat lain.
Dua ilmuwan ini juga mencetuskan teori asam basa konjugasi. Asam konjugasi adalah basa yang menerima ion H+, sedangkan basa konjugasi adalah asam yang telah mendonorkan atau melepaskan ion H+.
Sebagai contoh, ketika asam asetat (CH3COOH) dilarutkan dalam air, maka akan terjadi reaksi berikut ini:
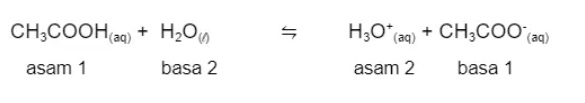
Sementara H3O+ adalah asam konjugasi karena kelebihan ion H+ dibandingkan zat asalnya, yaitu H2O. Pasangan CH3COOH dan CH3COO- disebut pasangan asam basa konjugasi.
Dalam teori asam basa Bronsted Lowry, ada kondisi dan reaksi tertentu di mana suatu senyawa dapat berperan sebagai basa meskipun tidak mengandung OH-, sedangkan dalam reaksi lainnya senyawa tersebut berperan sebagai basa. Senyawa yang memiliki sifat amfiprotik dan berperan sebagai amfoter.
3. Teori Asam Basa Lewis
Teori asam basa Lewis ini dicetuskan oleh ahli kimia dari UC Berkeley, Gilbert Newton Lewis, pada tahun 1923. Lewis menawarkan adanya teori alternatif yang lebih mudah untuk menjelaskan asam dan basa.
Alhasil, Lewis memberikan penjelasan yang lebih luas lagi terkait dengan asam basa.Lewis memiliki opini bahwa asam dan basa adalah suatu senyawa yang mempunyai senyawa dan juga ikatan.
Lebih lanjut, Lewis mengatakan bahwa asam merupakan suatu akseptor pasangan dari elektron. Contoh dari asam menurut Lewis adalah BF3, AlF3, serta SO3. Sedangkan basa menurut Lewis adalah molekul yang mampu memberikan pasangan elektron bebas, seperti Cl- dan ROH.
Teori dari Lewis ini diklaim menjadi teori yang memiliki kelebihan untuk mencari tahu reaksi dari asam-basa yang ada di dalam benda padat, gas, serta medium pelarut lainnya. Teori dari Lewis ini berbeda dari argumen Bronsted-Lowry karena menurut teorinya tidak melibatkan pengiriman dan penerimaan proton.
Selain itu, keunggulan dari teori Lewis adalah bisa menjelaskan sifat asam basa dalam molekul atau ion yang menerima pasangan elektron atau memiliki elektron bebas. Teori asam basa juga mampu menjelaskan sifat basa dari zat organik yang memiliki pasangan elektron bebas dan mengandung atom nitrogen.
Menurut Gilbert Newton Lewis asam adalah suatu molekul yang bisa menerima pasangan elektronnya. Sedangkan basa adalah molekul yang memberikan pasangan elektronnya.
Dibandingkan dengan teori asam basa lainnya, teori menurut Lewis ini memiliki keunggulan yang lebih banyak, seperti mampu menjelaskan sifat asam dan basa di dalam pelarut air, selain air, dan bahkan tanpa pelarut apapun.
Demikianlah uraian mengenai teori asam basa menurut ahli, semoga bermanfaat!
Editor : Muri Setiawan