Mengenal Larutan Elektrolit dan Larutan Non Elektrolit



PANGKALPINANG, Lintasbabel.iNews.id - Mengenal larutan elektrolit dan larutan non elektrolit, bisa kamu simak dalam ulasan berikut ini. Larutan berbeda dengan air yang umum kita kenal. Larutan merupakan suatu campuran yang bersifat homogen, yang terdiri dari dua atau lebih zat. Dia memiliki komposisi yang merata atau setiap bagian volumenya, akan memiliki komposisi atau sifat yang sama.
Zat yang jumlahnya lebih sedikit disebut zat terlarut atau solut, dan zat yang jumlahnya lebih banyak daripada zat lain disebut pelarut. Contohnya seperti larutan gula, dimana gula adalah zat terlarut, dan air adalah pelarut.
Nah, dalam ilmu Kimia, larutan ada beberapa jenis, diantaranya larutan elektrolit dan larutan non elektrolit.
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Menurut teori ionisasi Arrhenius, larutan elektrolit dapat menghantarkan listrik karena terdapat ion-ion yang bergerak bebas dalam larutan. Ion-ion tersebut yang berperan dalam menghantarkan arus listrik melalui larutan.
Berdasar proses pembentukan ion-ionnya (ionisasi), larutan elektrolit dibagi menjadi 2 jenis, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.
Larutan Elektrolit Kuat adalah larutan elektrolit yang terurai sempurna menjadi ion atau mengalami ionisasi sepenuhnya dalam larutan air atau dalam keadaan lebur. Karena sifat inilah larutan yang dapat menghantarkan listrik paling baik adalah larutan yang masuk dalam kelompok larutan elektrolit kuat.
Ciri-ciri larutan elektrolit kuat yaitu larutan yang sepenuhnya terionisasi untuk membentuk ion bebas ketika dilarutkan, dan tidak ada molekul netral yang terbentuk dalam larutan. Artinya, semakin banyak tersedianya ion bebas dalam suatu elektrolit, semakin besar kapasitasnya untuk membawa atau menghantarkan arus listrik.
Larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Contoh larutan elektrolit kuat yang paling mudah dijumpai dalam kehidupan sehari-hari adalah garam dapur. Garam sendiri memiliki molekul yang dapat terionisasi jika dilarutkan, dan akan memberikan larutan tersebut kemampuan untuk menghantarkan listrik.
Garam dapur padat tidak dapat menghantarkan listrik, tetapi ketika garam dilarutkan, ion-ionnya yang dapat bergerak bebas dalam larutan, dan memungkinkan muatan mengalir. Sedangkan, ion-ion garam dalam keadaan padat terikat dengan gaya antar partikel yang kuat. Oleh karena itu, mereka tidak bebas bergerak dalam keadaan padat dan tidak dapat menghantarkan listrik.
Larutan Elektrolit Lemah yaitu elektrolit yang tidak terurai sempurna menjadi ion, atau mengalami ionisasi sebagian, sehingga jumlah zat yang terurai menjadi ion tidak banyak dan menjadi penghantar listrik yang buruk.
Adapun ciri-ciri larutan elektrolit lemah adalah hanya sebagian terionisasi dalam air (biasanya 1% sampai 10%). Elektrolit lemah tidak seefisien elektrolit kuat dalam menghantarkan listrik.
Zat-zat dalam larutan elektrolit lemah biasanya meliputi asam lemah dan basa lemah, yang sebagian besar merupakan senyawa kovalen. Beberapa molekul netral hadir dalam larutan elektrolit lemah ini.
Contoh larutan elektrolit lemah adalah CH3COOH (asam asetat), N4OH, HCN (hidrogen sianida), dan Al (OH)3, termasuk air.
Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan listrik, karena zat-zat yang dilarutkan tidak menghasilkan ion atau tidak mengalami ionisasi sama sekali.
Contoh larutan non elektrolit adalah Etil alkohol (etanol), yang tidak terionisasi ketika dilarutkan dalam air. Contoh lainnya adalah glukosa dalam air, yang membentuk larutan non elektrolit karena meskipun gula larut dalam air, namun gula tetap mempertahankan identitas kimianya.
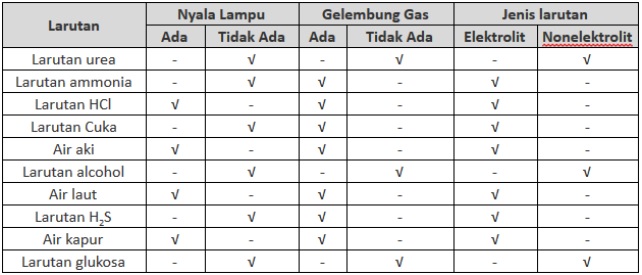
Berikut ini adalah contoh Larutan Elektrolit dan Larutan Non Elektrolit:
Editor : Muri Setiawan