Tata Nama Senyawa, Pelajar SMA Wajib Tahu Soal Ini


PANGKALPINANG, Lintasbabel.iNews.id - Tata nama senyawa kimia dapat kamu pelajari pada pembahasan artikel berikut ini. Mengenal senyawa adalah pelajaran wajib bagi pelajaran Kimia di Sekolah Menengah Atas alias SMA. Karena itu, kamu para pelajar harus tahu tata nama senyawa kimi apa saja.
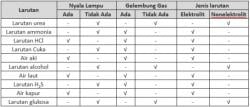
Tana nama senyawa adalah serangkaian aturan persenyawaan kimia yang disusun secara sistematis. Tata nama kimia tidak boleh sembarangan dibuat, namun disusun berdasarkan aturan IUPAC (International Union of Pure and Applied Chemistry).

Setidaknya ada 3 senyawa yang akan kita bahas kali ini, yakni Senyawa Ionik, Senyawa Molekuler, dan Senyawa Ion Poliatomik. Berikut ulasan singkat ketiganya, yang telah kami rangkum dari berbagai sumber.
Senyawa ionik terbentuk dari kation (ion positif) dan anion (ion negatif). Kebanyakan senyawa ini adalah senyawa biner, yaitu senyawa yang terbentuk hanya dari dua unsur.
Untuk senyawa ionik biner, penamaan dimulai dari kation logam kemudian diikuti anion nonlogam dan diberi akhiran -ida.
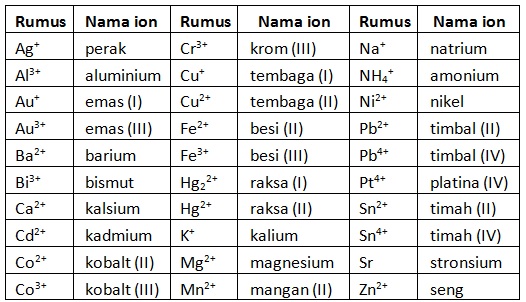
Untuk kation yang memiliki lebih dari satu jenis muatan (bilangan oksidasi), diberikan keterangan angka romawi di tengahnya sesuai besarnya muatan.
Contoh-Contoh:
Bagaimana kita menamakan BaCl2?.
Jawabannya, adalah BaCl2 tersusun atas Ba2+ (ion barium) sebagai kation dan Cl– (ion klorida) sebagai anion, sehingga BaCl2 dinamakan barium klorida. (Ini merupakan suatu contoh senyawa antara logam dan nonlogam.)
Bagaimana menamakan Mg3(PO4)2?
Jawaban : Mg3(PO4)2 tersusun atas Mg2+ (ion magnesium) sebagai kation dan PO43- (ion fosfat) sebagai anion, sehingga Mg3(PO4)2 dinamakan magnesium fosfat. (Ini merupakan contoh senyawa ion yang terbentuk dari suatu kation dengan suatu anion poliatom.)
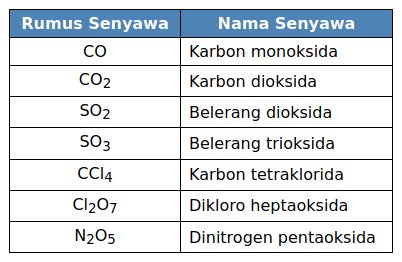
Contoh Penamaan Senyawa Molekular. Foto: Net.
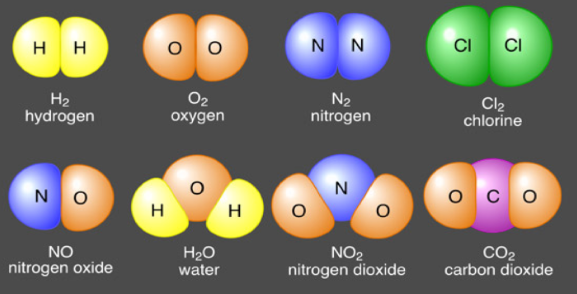
Senyawa molekuler termasuk juga senyawa biner. Senyawa molekuler tersusun dari unsur-unsur nonlogam.

Penamaan senyawa ini dimulai dari unsur nonlogam pertama, lalu diikuti nama unsur nonlogam yang diberi akhiran -ida.

Jika dua unsur nonlogam dapat membentuk lebih dari dua jenis senyawa, digunakan awalan bahasa Yunani, yaitu suatu awalan yang sesuai dengan indeks dalam rumus kimianya.
Senyawa molekuler yang mengandung hidrogen, tidak menggunakan awalan bahasa Yunani, tetapi menggunakan nama umum yang tidak sistematis.
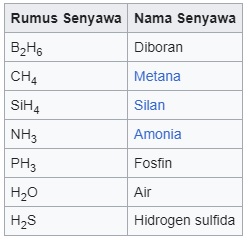

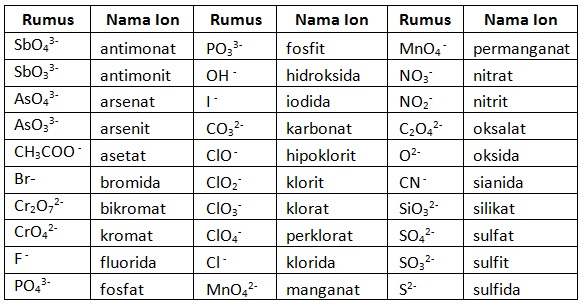
Penamaan senyawa ion poliatomik dimulai dari ion positif (kation) lalu dilanjutkan dengan ion negatif (anion).
Untuk ion logam yang memiliki lebih dari satu jenis muatan, diberikan keterangan angka romawi di tengahnya sesuai besar muatan.
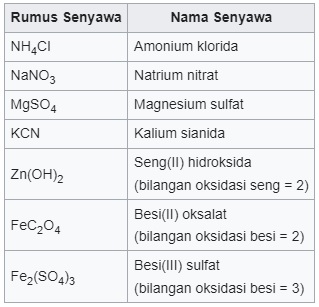
Selain ketiga senyawa di atas, ada juga penamaan asam dan basa.
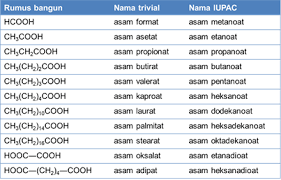
Asam biner (terdiri dari dua jenis unsur), penamaannya dimulai dari kata asam lalu diikuti nama sisa asamnya. Untuk asam yang terdiri dari tiga jenis unsur, penamaan dimulai dari kata asam lalu diikuti nama sisa asamnya, yaitu anion poliatom.

Sementara, penamaan basa pada umumnya, senyawa ion yang terdiri dari kation logam dan anion OH-. Senyawa basa dibentuk oleh ion logam sebagai kation dan ion OH- atau ion hidroksida sebagai anion.
Penamaan senyawa basa dilakukan dengan menuliskan nama logam (kation) di depan kata hidroksida.
Itulah tadi penjelasan singkat tentang taata cara penamaan senyawa, semoga bermanfaat!
Editor : Muri Setiawan