Laju Reaksi: Konsep, Faktor, Rumus, dan Contohnya


PANGKALPINANG, Lintasbabel.iNews.id - Laju reaksi, konsep, faktor, beserta rumus dan contoh-contohnya bisa kamu ketahui di dalam artikel berikut ini. Karenanya, simak ulasannya sampai selesai, ya!
Laju reaksi adalah kecepatan dimana reaksi kimia terjadi dalam suatu sistem. Hal ini berkaitan dengan seberapa cepat reaktan diubah menjadi produk akhir.
Ada beberapa faktor yang mempengaruhi laju reaksi, serta rumus dan contoh soal persamaan laju reaksi yang dapat dijelaskan sebagai berikut.
Luas Permukaan Bidang Sentuh
Luas permukaan bidang sentuh antara zat-zat reaktan berpengaruh terhadap kecepatan reaksi. Semakin besar luas permukaan, semakin banyak area tumbukan antara partikel-partikel zat, yang memungkinkan reaksi terjadi lebih cepat.
Konsentrasi
Konsentrasi zat-zat reaktan memainkan peran penting dalam menentukan laju reaksi. Semakin tinggi konsentrasi, semakin sering tumbukan antara partikel-partikel zat, dan oleh karena itu, reaksi terjadi dengan lebih cepat.
Kenaikan Suhu
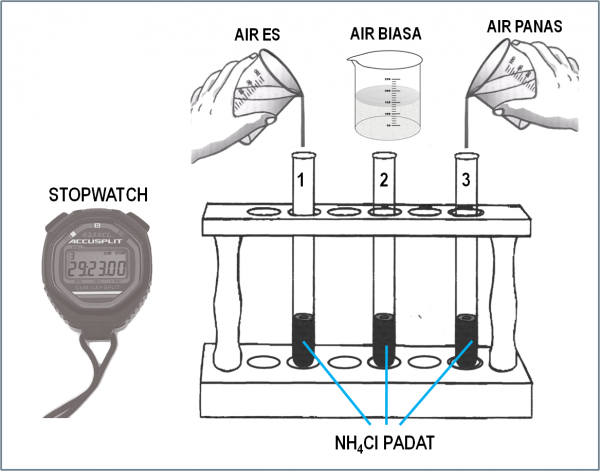
Suhu juga mempengaruhi laju reaksi. Ketika suhu naik, energi kinetik partikel-partikel zat meningkat, mengakibatkan lebih banyak tumbukan yang efektif dan reaksi yang lebih cepat.
Katalis
Katalis adalah zat yang dapat mempercepat laju reaksi tanpa ikut berubah dalam reaksi tersebut. Katalis positif atau katalisator meningkatkan laju reaksi, sementara katalis negatif atau inhibitor dapat memperlambat laju reaksi.
Persamaan laju reaksi adalah representasi matematika dari bagaimana konsentrasi pereaksi mempengaruhi laju reaksi. Persamaan ini dikenal juga sebagai hukum reaksi. Persamaan laju reaksi umumnya dapat ditulis sebagai berikut: xA + yB → produk.
Rumus yang umum digunakan untuk menggambarkan laju reaksi adalah:
v = k [A]"m [B]"n
Keterangan:
v adalah laju reaksi.
[A] adalah konsentrasi zat A.
[B] adalah konsentrasi zat B.
m dan n adalah orde reaksi zat A dan B, masing-masing.
k adalah konstanta laju reaksi.
Misalkan kita memiliki reaksi: A + 2B → C. Jika laju reaksi sebanding dengan [A] dan [B]"2, maka persamaan laju reaksi dapat ditulis sebagai:
v = k [A]"1 [B]"2
Jika konsentrasi [A] = 0.1 M dan [B] = 0.2 M, serta k = 0.005 M/s, hitunglah laju reaksi pada saat tersebut.
v = 0.005 M/s * (0.1 M)"1 * (0.2 M)"2
v = 0.005 * 0.1 * 0.04
v = 0.00002 M/s
Jadi, laju reaksi pada saat tersebut adalah 0.00002 M/s.
Dengan pemahaman tentang faktor-faktor yang mempengaruhi laju reaksi, persamaan laju reaksi, dan contoh soal di atas, kita dapat menganalisis dan memprediksi kecepatan reaksi dalam berbagai kondisi kimia.
Itulah tadi penjelasan tentang laju reaksi, semoga bermanfaat!
Editor : Muri Setiawan












